Kontaktkorrosion

Kontaktkorrosion tritt auf, wenn zwei unterschiedliche metallische Materialien miteinander in Kontakt kommen und dabei eine chemische Reaktion auslösen, die zur Beschädigung oder Zersetzung der betroffenen Metalle führt. Dies kann durch Feuchtigkeit, Salze oder andere elektrolytische Flüssigkeiten beschleunigt werden. Kontaktkorrosion ist ein wichtiges Problem in der Metallverarbeitung und kann durch geeignete Materialauswahl, Isolierung oder Verwendung von Trennschichten verhindert werden.
Wann kommt es zur Kontaktkorrosion
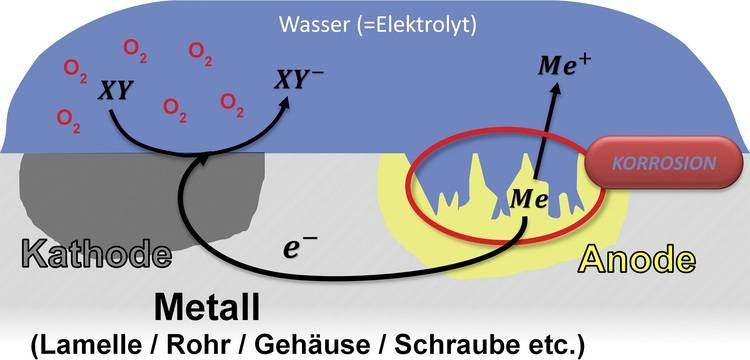
Kontaktkorrosion tritt auf, wenn zwei unterschiedliche metallische Materialien direkt miteinander in Kontakt kommen und dabei eine elektrochemische Reaktion ausgelöst wird, die zu Beschädigungen führt. Dabei wird das unedlere Metall, das eine niedrigere elektrochemische Spannungsreihe aufweist, bevorzugt korrodieren, während das edlere Werkstoffe geschützt bleibt. Schrauben sind das populärste Beispiel für Kontaktkorrosion.
Kontaktkorrosion tritt häufig in feuchten oder salzhaltigen Umgebungen auf, bei denen eine elektrolytische Verbindung zwischen den beiden Metallen besteht. Beispiele hierfür sind der Kontakt von Aluminium mit Kupfer, Messing oder Stahl in feuchten Bedingungen, oder der Kontakt von verzinktem Stahl mit Kupfer in salzhaltiger Wasser-Umgebungen.
Kontaktkorrosion kann auch durch andere Faktoren beeinflusst werden, wie zum Beispiel die Ober-flächenverhältnis der Metalle, die Art der Beschichtungen oder die Anwesenheit von anderen Verunreinigungen. Um Kontaktkorrosion zu vermeiden, sollten geeignete Materialpaarungen und Korrosionsschutzmaßnahmen gewählt werden, wie zum Beispiel Trennschichten oder Barriereschichten.
Typische Beispiele sind:
- Bei Verbindungen von Metallbauteilen oder -komponenten, z.B. in Konstruktionen, Rohrsystemen oder Maschinen.
- Bei Kontakt zwischen Metallteilen und Befestigungsmitteln wie Schrauben, Muttern oder Bolzen.
- Bei Verbindungen von Metall und anderen Materialien wie Beton, Kunststoffen oder Glas.
- In elektronischen Bauteilen, insbesondere in Batterien oder Leiterplatten.
Welche Metalle korrodieren?
Grundsätzlich können alle metallischen Materialien durch Korrosion beschädigt werden, jedoch gibt es einige Metalle, die besonders anfällig für elektrolytische Verbindungen sind. Hier unterscheiden sich vor allem "Edle" und "unedle" Metalle die unterschiedliche Reaktivitäten aufweisen. Edle sind in der Regel weniger reaktiv und korrosionsbeständiger als unedle Metalle.
In der elektrochemischen Spannungsreihe werden Metalle in der Reihenfolge ihrer elektrochemischen Aktivität angeordnet. Edle befinden sich in der Regel auf der rechten Seite der Spannungsreihe und haben eine höhere elektrochemische Aktivität. Unedle Metalle befinden sich auf der linken Seite der Spannungsreihe und haben eine niedrigere elektrochemische Aktivität.
Wenn ein edles Metall in Kontakt mit einem unedlen kommt, kann es zu einer elektrochemischen Reaktion kommen, bei der das unedle Metall korrodiert und das edle Metall geschützt wird. Dieses Phänomen wird als "Galvanische Korrosion" oder "Bimetallkorrosion" bezeichnet.
Einige Beispiele für edle Metalle sind Gold, Platin und Silber. Diese sind aufgrund ihrer hohen Korrosionsbeständigkeit und chemischen Stabilität für Schmuck, elektronische Bauteile und medizinische Geräte sehr gefragt.
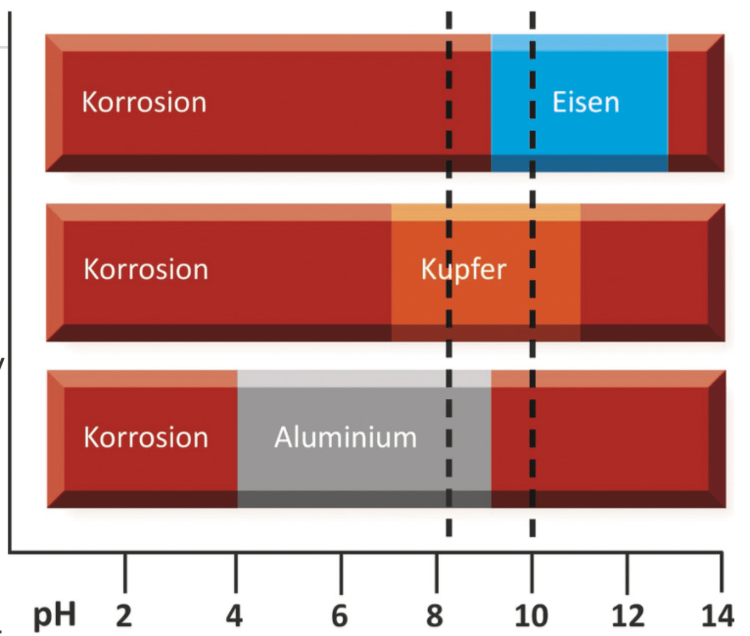
Beispiele für unedle Metalle sind Eisen, Aluminium und Zink. Diese sind weniger korrosionsbeständig und werden oft durch Korrosion oder Oxidation beschädigt.
Einige der am häufigsten korrodierenden Metalle sind:
- Eisen und Stahl: Diese Metalle sind sehr anfällig für Korrosion, insbesondere bei Feuchtigkeit und Salzen. Rost ist eine Form der Eisenkorrosion.
- Kupfer: Kupfer ist anfällig für Korrosion durch Säuren, Salze und Feuchtigkeit. Das grüne Material, das auf altem Kupfer zu sehen ist, ist eine Form der Kupferkorrosion.
- Aluminium: Aluminium ist anfällig für Korrosion durch Feuchtigkeit und Salze. Weiße Flecken auf Aluminium sind ein Anzeichen für Korrosion.
- Zink: Zink wird häufig als Schutzschicht für andere Metalle eingesetzt (verzinkte Metalle), aber es kann selbst auch korrodieren, besonders bei Feuchtigkeit und Säuren.
- Messing: Messing kann durch Säuren, Feuchtigkeit und Salze korrodieren.
Es ist wichtig zu beachten, dass jedes Metall unter bestimmten Bedingungen korrodieren kann. Die Anfälligkeit für Korrosion hängt von der Zusammensetzung des Metalls, seiner Umgebung und anderen Faktoren ab. Um Korrosion zu vermeiden, sollten geeignete Schutzmaßnahmen wie Beschichtungen, Anoden oder Legierungen eingesetzt werden.
DIN EN ISO 8044 bestimmt Korrosionsrate von Metallen
Die DIN EN ISO 8044 ist eine Norm, die die Methoden zur Bestimmung der Korrosionsrate von Metallen und Legierungen definiert. Sie beschreibt verschiedene Verfahren zur Messung der Korrosionsrate, einschließlich Gewichtsverlust, elektrochemischer Techniken und Korrosionsüberwachungssystemen.
Weiterführende Informationen:
So werden Rohrleitungen langfristig vor Kalk und Korrosion geschützt